医科2018.11.17 講演
[保険診療のてびき]
最新リウマチ治療の目標とその最適化 (2018年11月17日)
神戸大学大学院保健学研究科 病態解析学領域 臨床免疫学教授 柱本 照先生講演
関節リウマチ(RA)とは
関節リウマチ(Rheumatoid arthritis:以下RA)は、寛解と再燃を繰り返しながら経過する多発関節炎で、関節炎の活動期には関節の腫脹・熱感と強い疼痛を伴う。有病率は0.4%程度、本邦の患者数は約80万人と考えられ、女性の罹患率は男性の約5倍、発症のピークは40歳代を中心とする。発症前段階から、リンパ節では樹状細胞、マクロファージやB細胞による抗原提示が行われ、シトルリン化蛋白質による自己免疫応答が発生する。発症後、病態の首座をなす関節滑膜には多くのCD4陽性ヘルパーT細胞が存在し、関節液中のB細胞、好中球、マクロファージと共に、白血球、滑膜線維芽細胞(滑膜細胞)、軟骨細胞、破骨細胞などより構成される炎症のフィードバックループが関節リウマチの慢性持続性炎症を駆動する。
RAの炎症メカニズム
RAの病態形成に関係する炎症メディエーターの一つがCyclooxygenase(COX)で、COXには構成的に臓器に発現するCOX-1と、炎症誘導性に発現するCOX-2の、二つのアイソフォームが存在する。RA滑膜組織にはCOX-2が著明に発現し、アラキドン酸代謝経路においてCOXの下流域で調節を受けるプロスタグランジンを介して、疼痛、熱感、血管新生など、RAの病態に深く関与する。腫瘍壊死因子Tumor necrosis factor(TNF)は、現在、RA治療の現場で用いられるサイトカイン拮抗性生物学的製剤の治療標的であるが、その炎症惹起作用、接着分子を介した細胞浸潤の活性化、血管新生作用、骨軟骨破壊の亢進作用などによりRAの病態を強く増悪させる。もう一つの治療標的であるサイトカインがインターロイキン6(Interleukin-6:IL-6)で、IL-6はRA発症初期の自己免疫反応発現時にナイーブT細胞からTh17細胞への分化を誘導し、制御性T細胞に拮抗的に作用して病態を進行させる。さらに、RA後期の慢性炎症期には関節滑膜の炎症と増殖、骨軟骨破壊の増悪作用に加え、シグナル伝達性転写因子(Signal Transducer and Activator of Transcription3:STAT3)転写亢進を介したアミロイドA蛋白の産生増強をもたらす。
マトリックスメタロプロテアーゼ3(Matrix metalloproteinase3:MMP3)は滑膜細胞や軟骨細胞から分泌される蛋白分解酵素で、RA罹患関節液の総MMP3量は、その抑制物質Tissue inhibitor of MMP(TIMP)総量を上回っており、関節炎の経過中、特に軟骨の代謝回転に影響して直接的に関節破壊を促進させる。
RA患者に見られる関節破壊は、典型例では手指MCP関節の尺側偏位やスワンネック変形・ボタンホール変形を引き起こすが、そのX線像は関節軟骨辺縁骨膜起始部の滑膜増殖により骨辺縁が浸食されるmarginal erosionとして捉えられる。全身の全ての滑膜関節は罹患関節となり得るが、関節外症状としての眼症状(強膜炎・角膜炎)、間質性肺炎・肺線維症、漿膜炎(心膜炎・胸膜炎)、消耗性貧血や血小板増多、皮膚潰瘍、筋萎縮、末梢神経障害、アミロイド症(消化管・腎)にも注意を要する。さらに、RA合併骨粗鬆症は重要な合併症であり、炎症に由来する傍関節性骨粗鬆症、運動制限による廃用性骨粗鬆症、ステロイド性骨粗鬆症には、それぞれ原因に応じた対応を要する。
寛解を見据えた治療戦略
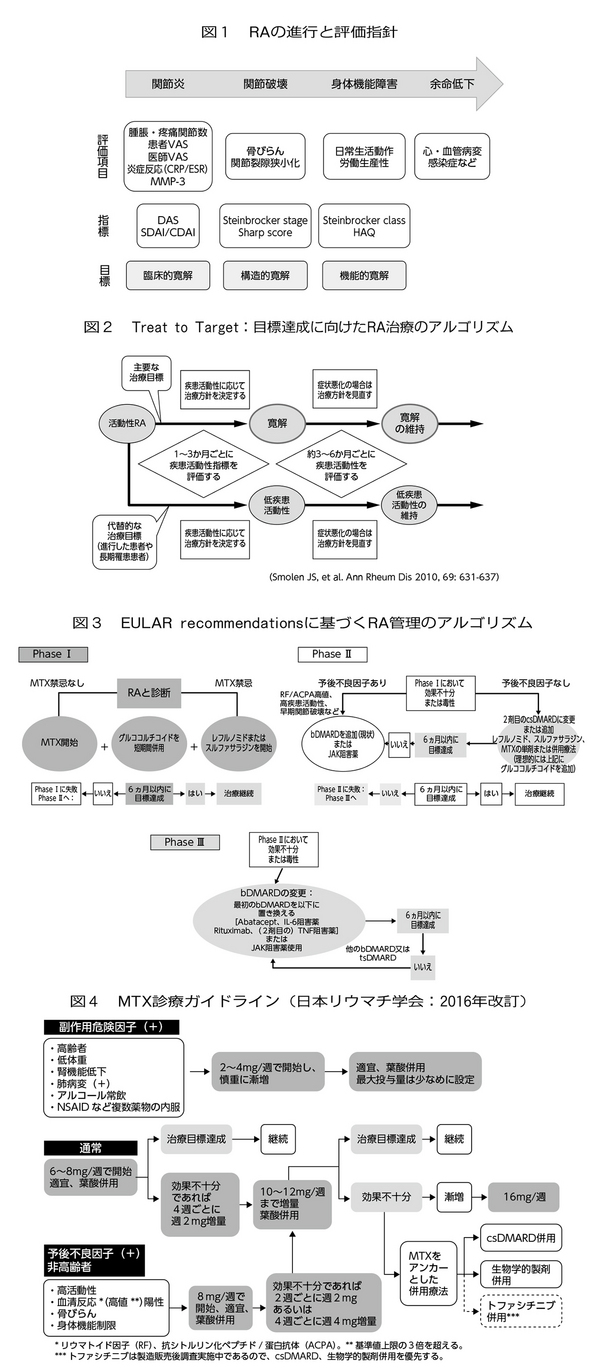
昨今、関節リウマチ診療は「臨床的寛解」、「構造的寛解」、「機能的寛解」の達成を見据えた治療戦略を問われる時代となった(図1)。2010年にACR/EULAR(American College of Rheumatology/European League Against Rheumatism)新分類基準が発表され、翌2011年には新しい寛解基準とともに治療目標達成に向けた指針"Treating rheumatoid arthritis to target: T to T"が提唱された(図2)。その後、2013/2016年のEULARリコメンデーションにより、アンカードラッグ(基準薬剤)としてのメトトレキサート(Methotrexate:MTX)に加え、生物学的製剤や低分子量抗リウマチ薬の導入と変更の基準が広く示された(図3)。RA管理のアルゴリズム
日本リウマチ学会によるMTX診療ガイドラインを図4に示す。MTXの投与に際しては、容量依存性に発生する骨髄抑制やリンパ増殖性疾患、容量非依存性に発生する間質性肺炎、B型劇症肝炎などの重篤な副作用に加え、口内炎をはじめとする消化器症状、肝機能障害、脱毛などに対しても十分な留意が必要で、特にMTX関連リンパ増殖性疾患は節外病変が多数を占めるため、発熱・倦怠感・食思不振などの軽微な症状を見逃さず、血清LDH値、GOT値、IL-2受容体値などを適切にモニターすることが肝要である。図3のごとく、phase Iで治療反応性が乏しく、予後不良因子を持つ症例に対しては生物学的製剤(biological disease modifying anti-rheumatic drugs:bDMARDs)やヤヌスキナーゼ(Janus kinase:JAK)阻害剤の導入を考慮する。EULARが提唱するbDMARDs導入の原則は、以下の通りである。(1)TNF阻害薬(adalimumab、certolizumab、etanercept、golimumab、infliximabまたは十分研究により承認されたbiosimilars)、abatacept、IL-6阻害薬のいずれもが第一選択となり得る。(2)MTXなどの従来型抗リウマチ薬が併用できない症例においては、IL-6阻害薬またはJAK阻害剤に一定のアドバンテージがある。(3)現在はJAK阻害薬に比べ、長期実績のあるbDMARD(MTXもしくは他の従来型抗リウマチ薬と併用)が主流であろう。
添付文書上infliximabにはMTXの併用が必須であるが、いずれのbDMARDsもMTXとの併用で効果が増強される。疾患活動性が寛解を長期間維持できれば、従来型DMARD併用のもとbDMARDs減量も考慮されるが、これまでの報告から寛解維持の期間は1年以上が望ましく、bDMARD減量により薬物血中濃度が低下して薬剤抵抗性抗体が出現しやすくなることに留意が必要である。昨今は、MTX忍容性が低い患者に対してbDMARD投与量を維持し、MTX減量を試みるケースも増えているが、この場合でもMTXの完全な休薬は勧められない。
現在、本邦で使用される二つのJAK阻害剤は、MTXをはじめとする少なくとも1剤の抗リウマチ薬に不応性の症例に投与可能で、その投与選択の位置付けはbDMARDsと同等である。JAK阻害剤の投与に際しては、帯状疱疹の発生率がアジア系人種で高く、特に50歳から80歳に至る年齢層では罹患率が上昇することに留意する必要がある。
(2018年11月17日、薬科部研究会より、小見出しは編集部)